Die Frage, ob die Oberflächenrauigkeit eines Zirkonoxidimplantats einen Einfluss auf dessen Osseointegrationsfähigkeit hat, ist bereits seit einigen Jahren Gegenstand der wissenschaftlichen Diskussion um Keramikimplantate. Studien assoziieren Zirkonoxidimplantate mit glatten enossalen Oberflächen mit vergleichsweise langen Einheilzeiten.[1,2, 3, 4] Dies deckt sich mit den Ergebnissen von Cionca et al., die besagen, dass die enossale Oberfläche eines Zirkonoxidimplantats so rau wie möglich sein sollte, um eine zuverlässige Osseointegration zu erreichen.[5]
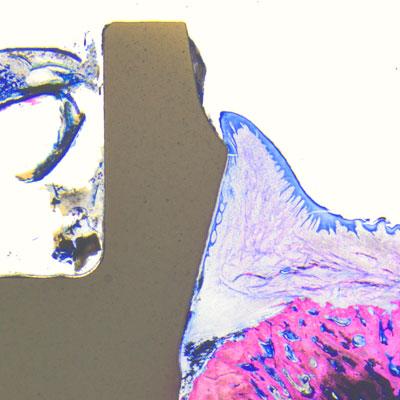
Die histologischen Proben wurden mit Leica-Lichtmikroskopen analysiert und der Knochen-Implantat-Kontakt (BIC) wurde vom krestalsten Knochen-Implantat-Kontaktpunkt bis hin zum Apex des Implantats gemessen (© Peter Schüpbach).
Um Auskunft darüber geben zu können, ob eine hohe enossale Oberflächenrauigkeit zu einer beschleunigten und zuverlässigen Osseointegration von Zirkonoxidimplantaten führt, führten die Schweizer Forscher Dr. Roland Glauser und Dr. Peter Schüpbach eine experimentelle präklinische Tierstudie durch, in der sie die frühe Knochenbildung und die Knochenheilungsmechanismen um zweiteilige Patent™ Implantate mit einer modifizierten, rauen enossalen Oberfläche untersuchten.[6] Sie fanden heraus, dass das Patent™ Implantat dank seiner hochgradig rauen BBS-Oberfläche alle anderen Zahnimplantate, die in vergleichbaren Studien bisher untersucht worden sind, in puncto Osseointegrationserfolg und -geschwindigkeit in den Schatten stellt. Die Ergebnisse ihrer Studie wurden nun offiziell im International Journal of Implant Dentistry unter dem Titel "Early bone formation around immediately placed two-piece tissue-level zirconia implants with a modified surface: an experimental study in the miniature pig mandible" publiziert (einsehbar unter: https://doi.org/10.1186/s40729-022-00437-z ).
Studiendesign
Bei vier Minischweinen (Spezies sus scrofa domesticus) wurden zunächst sechs Prämolaren extrahiert. Fünf Zirkonoxidimplantate mit einem Soft-Tissue-Level-Design (Patent™ Standard Two-piece Implantat; 4,1 mm Durchmesser und 11 mm Länge; Zircon Medical Management AG) und ein Kontrollimplantat aus Titan mit einem Tissue-Level-Design (Straumann® Standard RN Roxolid; 4,1 mm Durchmesser und 10 mm Länge; SLActive® Oberfläche) wurden unter Vollnarkose als Sofortimplantate in die Extraktionsalveolen der Tiere eingesetzt. Die untersuchten Patent™ Implantate werden in einem patentierten Herstellungsverfahren aus Yttrium-stabilisiertem Zirkoniumdioxid hergestellt. Bei diesem Verfahren wird die enossale Implantatoberfläche im Vorsinterstadium sandgestrahlt. Die resultierende BBS-Oberfläche ("blasted before sintering") weist eine enossale Rautiefe von Ra 5,7 µm auf. Diese hochraue Oberfläche ist etwa fünfmal rauer als die von anderen dokumentierten Zirkonoxidimplantaten.[7, 8] Der transmukosale Anteil des Patent™ Implantats ist maschiniert. Die Kontrollimplantate aus Titan weisen eine enossale Oberflächenrauigkeit von Ra 2,2 µm auf und haben ebenfalls einen maschinierten transmukosalen Anteil. Nach der Implantation wurden die gebildeten Lappen sorgfältig vernäht und die Implantate zur transmukosalen Einheilung belassen. Von einem Ausgleich des Knochenniveaus mithilfe von Augmentationsverfahren oder Membranen wurde bei allen Tiermodellen abgesehen. Während der Einheilung gingen keine Implantate verloren. Zwei Tiere wurden nach vier Wochen geopfert und zwei nach acht Wochen. Die histologischen Proben wurden mit Leica-Lichtmikroskopen analysiert. Der Knochen-Implantat-Kontakt (BIC) wurde vom krestalsten Knochen-Implantat-Kontaktpunkt bis hin zum Apex des Implantats gemessen.

Erkenntnisse

Die Patent™ Testimplantate zeigten vier und acht Wochen nach der Insertion hohe Osseointegrationsraten. Nach vier Wochen betrug der BIC für die Testimplantate 73,7 % (SD ± 16,8) und für die Kontrollimplantate 58,5 %. Nach acht Wochen Einheilung waren beide Implantattypen mit einem BIC von 82,4 % (SD ± 16,9) respektive 93,6 % (SD ± 9,1) vollständig osseointegriert. Eine Knochenbildung im Sinne einer Kontaktosteogenese wurde direkt auf und entlang der Oberfläche der Patent™ Implantate beobachtet. Die Autoren kommen zu dem Schluss, dass die untersuchte Oberfläche des Patent™ Implantats als hoch osteokonduktiv eingestuft werden kann. Sie stellen außerdem fest, dass das Vorhandensein von Knochenfragmenten von entscheidender Bedeutung ist, um den initialen Knochenbildungsprozess zu beschleunigen.[9] Während der Implantatinsertion kratzt eine raue Implantatoberfläche Knochenanteile entlang der Osteotomiewände ab. Dadurch entsteht eine mikrometerdicke Schmierschicht aus Knochenfragmenten und Blut, die einen Teil der Implantatoberfläche unmittelbar nach dem Einsetzen bedeckt.[10, 11] Die Knochenfragmente haben einen bedeutenden Einfluss auf die neue Knochenbildung durch Distanzosteogenese in Richtung der Implantatoberfläche. Die Autoren vermuten, dass die raue Oberfläche der Patent™ Testimplantate im Vergleich zu den Kontrollimplantaten ein höheres Maß an osteogenen Knochenfragmenten sowie eine ausgeprägtere Schmierschicht erzeugt haben könnte, was dem überaus hohen BIC nach vier Wochen Einheilung zuträglich war.
Fazit
Basierend auf ihren Erkenntnissen aus der experimentellen präklinischen Studie kommen die Autoren Dr. Glauser und Dr. Schüpbach zu dem Schluss, dass die enossale Oberflächenrauigkeit von Zirkonoxidimplantaten einen entscheidenden Einfluss auf ihre Osseointegrationsfähigkeit hat. Sie berichten, dass sofort inserierte zweiteilige Patent™ Implantate dank ihrer hochrauen enossalen BBS-Oberfläche eine schnelle und vorhersagbare Osseointegration erreichen. Die Ergebnisse dieser Tierstudie zeigen einen höheren durchschnittlichen BIC für die untersuchten Patent™ Implantate im Vergleich zu früheren Studien, in denen oberflächenmodifizierte Zirkonoxidimplantate in ähnlichen Tiermodellen untersucht worden sind.
Literatur
1. Akagawa Y, Ichikawa Y, Nikai H, Tsuru H. Interface histology of unloaded and early loaded partially stabilized zirconia endosseous implant in initial bone healing. J Prosthet Dent. 1993;69(6):599–604.
2. Scarano A, Di Carlo F, Quaranta M, Piatelli A. Bone response to zirconia ceramic implants: an experimental study in rabbits. J Oral Implantol. 2003;29(1):8–12.
3. Kohal RJ, Weng D, Bachle M, Strub JR. Loaded custom-made zirconia and titanium implants show similar osseointegration: an animal experiment. J Periodontol. 2004;75(9):1262–8.
4. Sennerby L, Dasmah A, Larsson B, Iverhed M. Bone tissue responses to surface-modified zirconia implants: a histomorphometric and removal torque study in the rabbit. Clin Implant Dent Relat Res. 2005;7(s1):s13–20.
5. Cionca N, Hashim D, Mombelli A. Zirconia dental implants: where are we now, and where are we heading? Periodontol. 2017;73(1):241–58.
6. Glauser, R., Schupbach, P. Early bone formation around immediately placed two-piece tissue-level zirconia implants with a modified surface: an experimental study in the miniature pig mandible. Int J Implant Dent 8, 37 (2022). https://doi.org/10.1186/s40729-022-00437-z
7. Oliva J, Oliva X, Oliva JD. One-year follow-up of first consecutive 100 Zirconia dental implants in humans: a comparison of 2 different rough surfaces. Int J Oral Maxillofac Implants. 2007;22(3):430–5.
8. Roehling S, Schlegel KA, Woelfler H, Gahlert M. Zirconia compared to titanium dental implants in preclinical studies—a systematic review and meta-analysis. Clin Oral Implants Res. 2019;30(5):365–95.
9. Bosshardt DD, Salvi GE, Huynh-Ba G, Ivanovski S, Donos N, Lang NP. The role of bone debris in early healing adjacent to hydrophilic and hydrophobic implant surfaces in man. Clin Oral Implants Res. 2011;22(4):357–64.
10. Dhore CR, Snel SJ, Jacques SV, Naert IE, Walboomers XF, Jansen JA. In vitro osteogenic potential of bone debris resulting from placement of titanium screw-type implants. Clin Oral Implants Res. 2008;19(6):606–11.
11. Tabassum A, Walboomers F, Wolke JG, Meijer GJ, Jansen JA. Influence of the surgical technique and surface roughness on the primary stability of an implant in artificial bone with a density equivalent to the maxillary bone: a laboratory study. Clin Implant Dent Relat Res. 2011;13(4):269–78.





